|
POR GANG LIU, Ph.D., diretor de P&D, Oamic Biotechnology, e JACO ZEEVAART, Ph.D., diretor científico, Oamic U.S.A. |
Furanona de morango (2,5-dimetil-4-hidroxi-3 [2H] -furanona) é um dos compostos aromáticos mais importantes na indústria de aromas, é usada em ampla variedade de sabores de alimentos e bebidas. A molécula foi identificada em frutas como abacaxi, morango, framboesa, manga, amora, toranja e tomate, e vários alimentos processados termicamente, como carne cozida, presunto, café e avelãs torradas. A Firmenich originalmente patenteou e comercializou essa molécula com o nome de marca registrada Furaneol.
Devido à sua popularidade e alta demanda, a produção comercial de furanona de morango tem sido objeto de estudos consideráveis nos últimos anos. Embora este valioso ingrediente esteja disponível em qualidades sintéticas e naturais, este artigo se concentrará apenas na produção do material sintético e, portanto, não inclui a fermentação e as rotas baseadas na reação de Maillard.
Apesar de muitas patentes e artigos descrevendo diferentes processos para obter furanona de morango, existem quatro rotas comerciais que respondem pela maioria dos produtos sintéticos no mercado.
Processo de acetileno-acetaldeído
A primeira rota comercial conhecida utilizou o processo de produção mostrado em F-1. O processo depende da ciclização catalisada por ácido do 2,5-dihidroxihexano-3,4-diona simétrico, que por sua vez foi derivado de hexino-2,5-diol. Uma vez que o derivado hexino não está disponível comercialmente, ele é preparado especificamente a partir de acetileno litiado e acetaldeído. Embora esse processo seja eficiente em termos de atômicos, ele requer o manuseio de materiais e reagentes inflamáveis e explosivos. Acredita-se que essa rota foi em grande parte descontinuada pela maioria dos fabricantes.
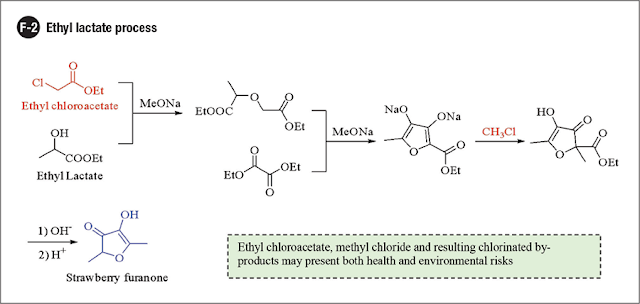
Processo de etil lactato
Esta abordagem segue uma via sintética linear de várias etapas representada em F-2. Esta abordagem depende da formação da ligação carbono-carbono para estabelecer o anel, ao invés de depender de uma reação final de condensação / ciclização do intermediário de seis carbonos intacto, como visto no processo de acetileno-acetaldeído e os dois processos discutidos a seguir.
Neste processo, a ligação éter, que acabará por se tornar a ligação C-O-C da estrutura do anel furano, é primeiro estabelecida em uma reação catalisada por base entre o lactato de etila e o cloroacetato de etila. O anel furano é montado em uma condensação de Claisen dupla entre o intermediário éter e o oxalato de dietila, com descarboxilação concomitante. A metilação na posição 5 introduz o segundo substituinte metil, após o que o produto é finalmente liberado após outra descarboxilação.
Uma variação desse processo envolve o uso de hidreto de sódio (NaH) como base, em vez de metóxido de sódio (NaOMe). Uma vez que o NaH é uma base mais forte, leva a uma conversão e rendimento aprimorados nas reações de substituição nucleofílica e de condensação de formação de anel. No entanto, o NaH é altamente sensível à umidade e requer um manuseio anidro e inerte especializado para evitar condições perigosas.
Processo de Propionaldeído
A rota do propionaldeído (F-3) prossegue através da intermediação da 3,4-hexanodiona, que é um ingrediente aromatizante em si (FEMA # 3168). A condensação de propionaldeído com benjoim catalisada por íons de tiazólio cria a estrutura de seis carbonos.
Outro passo chave neste processo é a bromação de 3,4-hexanodiona e a hidrólise subsequente do dibrometo para introduzir os grupos hidroxilo necessários nas posições 2 e 5. A alta corrosividade do bromo torna a operação de bromação perigosa e exige muito dos equipamentos do processo. O brometo de sódio deve ser recuperado para regenerar o reagente caro e para minimizar o impacto ambiental do fluxo de resíduos aquosos.
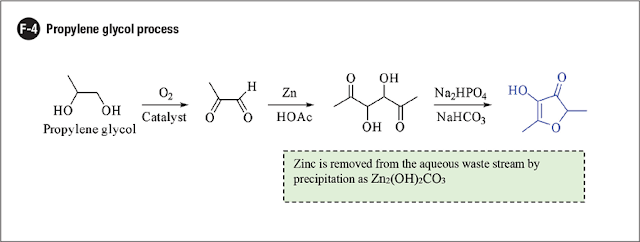
Processo de propilenoglicol
A etapa chave no processo de propilenoglicol (PG), descrito em F-4, é o acoplamento do tipo pinacol de metilo glioxal promovido por zinco / ácido acético. O 3,4-dihidroxihexano-2,5-diona simétrico resultante é um regioisômero do intermediário final do processo Firmenich original e, de modo semelhante, cicliza prontamente para produzir furanona de morango com bom rendimento.
O metil glioxal é obtido pela oxidação do PG ao ar em um reator de leito fixo utilizando prata como catalisador. Uma vez que o PG é um transportador de sabor amplamente utilizado, é um material inicial de grau alimentício conveniente, de baixo custo e prontamente disponível.
O fluxo aquoso de resíduos do processo é limpo por precipitação e filtração de zinco na forma de Zn2(OH)2CO3 sólido. Como é o caso para a maioria dos processos descritos anteriormente, a purificação final é feita por cristalização controlada de etanol de qualidade alimentar.
Fonte: Perfumery & Flavorist